Quaternisierung

Quaternisierung beschreibt in der Chemie die Überführung geeigneter Atome in den quartären Substitutionsgrad mit vier organischen Resten. Die Quaternisierung ist damit eine Untergruppe der Alkylierungen, durch die eine bestimmte Produktklasse entsteht. Hier erhält das Zentralatom vier gleiche oder verschiedene organische Substituenten und eine positive Ladung – es bildet sich also ein Kation aus.[1] Als Alkylierungsmittel werden etwa Halogenalkane oder Dimethylsulfat benutzt, das Gegenion (Anion) ist dann ein Halogenid, z. B. Chlorid, Bromid, Iodid, oder Sulfat beziehungsweise Methylsulfat.
Beispiele
Umwandlung von Aminen zu quartären Ammoniumverbindungen
Die Quaternisierung von tertiären Aminen zu quartären Ammoniumverbindungen ist anhand der Alkylierung eines tertiären Amins dargestellt (R = Organylgruppe, z. B. Alkylgruppe):[1]
| Quaternisierung von Aminen | Quaternisierung mit räumlich eingezeichnetem p-Orbital |
|---|---|
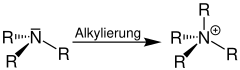 | 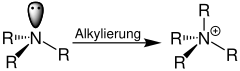 |
Wenn man von einem primären Amin (= Alkylamin) ausgeht und dieses stufenweise mit überschüssigem Halogenalkan umsetzt, erhält man über die Zwischenprodukte
- sekundäres Amin (= Dialkylamin) und
- tertiäres Amin (= Trialkylamin)
analog ein quartäres Ammoniumhalogenid.[2] Bei der Umsetzung von Trimethylamin mit Iodmethan entsteht Tetramethylammoniumiodid:
Analog entsteht bei der Umsetzung von Trimethylamin mit Brommethan das Tetramethylammoniumbromid:
Die einfachste quartären Ammoniumverbindung ist Tetramethylammoniumchlorid.
Umwandlung von Pyridin zu Pyridiniumverbindungen
Ein Beispiel für eine Quaternisierung ist die Reaktion von Pyridin zu einer Pyridiniumverbindung (R = Organylgruppe, z. B. Alkylgruppe):[1]
| Quaternisierung von Pyridin | Quaternisierung mit räumlich eingezeichnetem p-Orbital |
|---|---|
 |  |
Umwandlung von Phosphinen zu Phosphoniumsalzen
Auch die Reaktion eines Phosphans zu einer quartären Phosphoniumverbindung wird als Quaternisierung bezeichnet (R = Organylgruppe, z. B. Alkylgruppe):[1]
| Quaternisierung von Phosphanen | Quaternisierung mit räumlich eingezeichnetem p-Orbital |
|---|---|
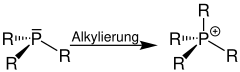 | 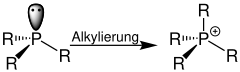 |
Als Alkylierungsmittel kann ein Halogenalkan – z. B. Brommethan – eingesetzt werden;[3] dabei erhält man ein Phosphoniumbromid.
Siehe auch
- Alkylierung
- Quartär
Einzelnachweise
- ↑ a b c d Jürgen Falbe, Manfred Regitz: Römpp-Chemie-Lexikon. 9. Auflage. Thieme, Stuttgart 1992, ISBN 3-13-735009-3, S. 3736.
- ↑ Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie, 5. Auflage, de Gruyter Verlag, Berlin 2015, ISBN 978-3-11-030559-3, S. 675.
- ↑ Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie, 5. Auflage, de Gruyter Verlag, Berlin 2015, ISBN 978-3-11-030559-3, S. 493.












